文|动脉橙果局
医保谈判之后,被称为“孤儿药”的诺西那生钠注射液一夜之间就火了。
促使其“走红”的原因有两个,一个是高兴,另一个是惊讶。“高兴”是因为70万一针的天价药诺西那生钠,在进入医保体系之后终于有了一个“亲民”的价格,这将给更多的人带来生的希望。
另一方面,诺西那生钠等罕见病药物的调入,意味着近年来多方呼吁的高值罕见病药纳入医保实现了零的突破,这为未来更多罕见药进入医保体系释放了积极的信号。
“惊讶”则是因为这种药的售价居然是70万一针,这极大地颠覆了大家对于药价的认知,不少网友甚至感叹,“这打一针的钱比我一辈子挣的钱还多!”。更让人感到窒息的是,诺西那生钠需要终身用药,第一年打6针,之后每4个月打1针,打就生效,不打就无效。
这对于患者以及其家庭来说,真的很残酷,一边是天价般的医药费,一边是可触及的死亡,不平衡的偏差之间开始产生了一种特殊的情绪,那就是对于药企的“敌视”,于是乎我们看到了诸如此类的热评:“定价这么高,药企到底要赚多少钱啊,能不能为患者考虑一下?”、“这么大的降价幅度都能接受,那证明药企还是有利润可赚,之前肯定赚了很多钱了吧!”、“药物研发出来不就是给患者用的吗,药价定的这么高,谁用得起啊,药企真是冒着良心赚钱。”

但事实真的如此吗?是,但又不完全是。
吃力又不讨好的“孤儿药”
如何定义“孤儿药”,官方给出了三个词,分别是患病人群少、市场需求少和研发成本高,别小看了这三个词,它几乎道尽了“孤儿药”研发的辛酸。
众所周知,新药研发是一个重体力活,除了要有核心技术之外,还需要有足够的时间和资本。根据目前的研究结果显示,一款“First-in-class”新药的研发成本(包含失败研发管线的平均成本)大约在10亿到20亿美元之间。
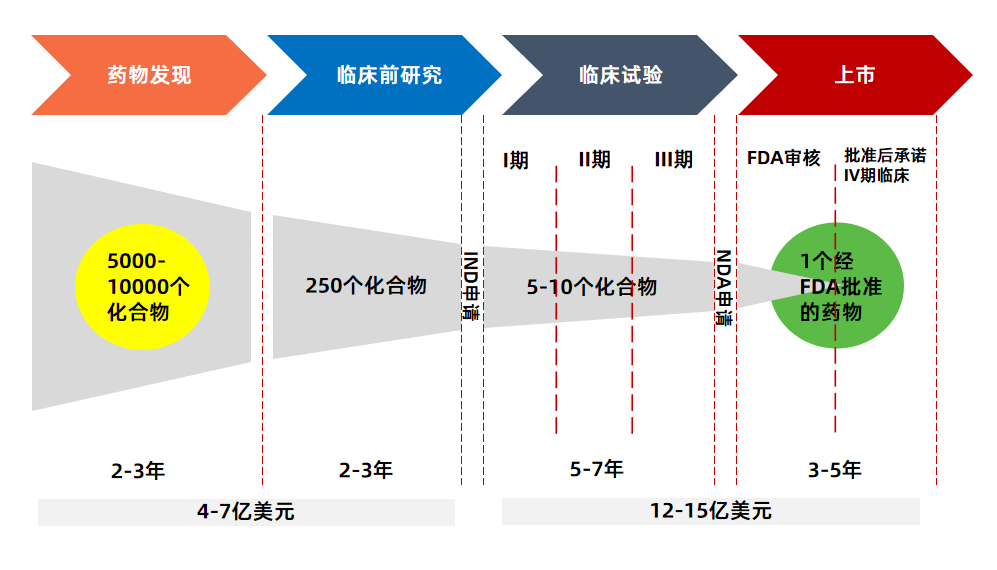
而在研发时间上,则需要10到15年,主要会经历药物发现、临床前研究、临床试验、上市四个关键阶段。其中,第三阶段“临床试验”最为耗时,一般需要5到7年。
这还是站在药物研发成功的基础上,如果失败了,一切都将付诸东流。根据数据统计,全球范围内,新药研发临床I、II、III期的平均成功率分别为63.2%、30.7%和58.1%,按照这个比例计算,从I期到上市,创新药临床研究的成功率不到10%。
创新药尚且如此,不受人待见的“孤儿药”在研发上只会更加艰难。
首先从技术上来讲,“孤儿药”的临床研究和入组面临着极大挑战。患者数据是对疾病开展针对性研究的基础,但“孤儿药”却在这方面显得“捉襟见肘”。一方面,治疗靶点的研究受制于孤儿病的发病机制研究不足、样本数量不足,所以临床研究的耗时很长,而且实验的终点设置难度较大;另一方面,患病人群少也使得临床实验的招募和入组比较困难。
这些“苛刻条件”几乎在初期就磨灭了研发人员对于“孤儿药”的热情。一位医学教授向动脉橙果局透露,“医生根本不愿意参加孤儿药相关的研究,因为一年可能也就碰到一两个病人,临床数据根本就支撑不起研究,花这个时间还不如去研究癌症或者经费更多的病种。”
其次从投入上来讲,漫长的时间和高额的成本足以逼退很多人。“孤儿药”由于患病人数少、研究资料缺乏、受试者难以寻找、致病机理复杂等原因,整体成本比一般创新药物研发要投入的更多。
以电影《我不是药神》中的白血病神药格列卫为例,诺华制药整整花了41年,总投入14亿美元才得以研发成功。
最后从回报上来讲,专利保护期使药企在获利上有了期限。对于药企来说,研发一款孤儿药先别想着赚钱,收回成本都很难。一方面是定价的问题,太低收不回成本,太高又找不到支付方,很容易出现争议;另一方面是市场体量的问题,孤儿病患者数量有限,而且由于药价昂贵,如果没有一个好的支付体系,真正能支付的微乎其微。
但最致命的还是专利保护期的问题。假如能锁定现在甚至将来所有病人只使用该药企研发的药物,那么收回成本只是时间问题。但是,由于专利已经公开,一旦过了保护期,其他制药企业就可以免费分享这一成果,并能依靠更低的价格迅速占据市场份额。到那时候,原研药企就有任何竞争力了,收益必然会出现“断崖式”下跌。
所以,从某种程度上来讲,研发“孤儿药”真的是一个吃力不讨好的事情。一方面,药企花了很大精力去做没有人愿意做的事情,这本身就是一个挑战;另一方面,药企做成功之后还要去平衡市场,如果定价高了,会落得“黑心企业”的臭名,如果定价低了,在专利保护期内又很难收回成本,最后只能赔本赚吆喝。
“孤儿药”需要被正向激励
研发“孤儿药”很难,所以更需要有人站出来。
但在这一点上,我们应该持有一个理性的认识:药企不是慈善机构,他们需要盈利,因为只有这样,他们才能维持企业的正常发展,才能投入更多的精力去创新,毕竟任何一款“孤儿药”都不是从天上掉下来的,而是药企用巨额的研发成本和研发时间换来的。
所以,如何让更多药企“站”出来去研发“孤儿药”是我们现阶段需要解决的问题。
近年来,随着技术的不断发展以及整体研发环境的改善,全球越来越多地药企开始投身于“孤儿药”的研发。
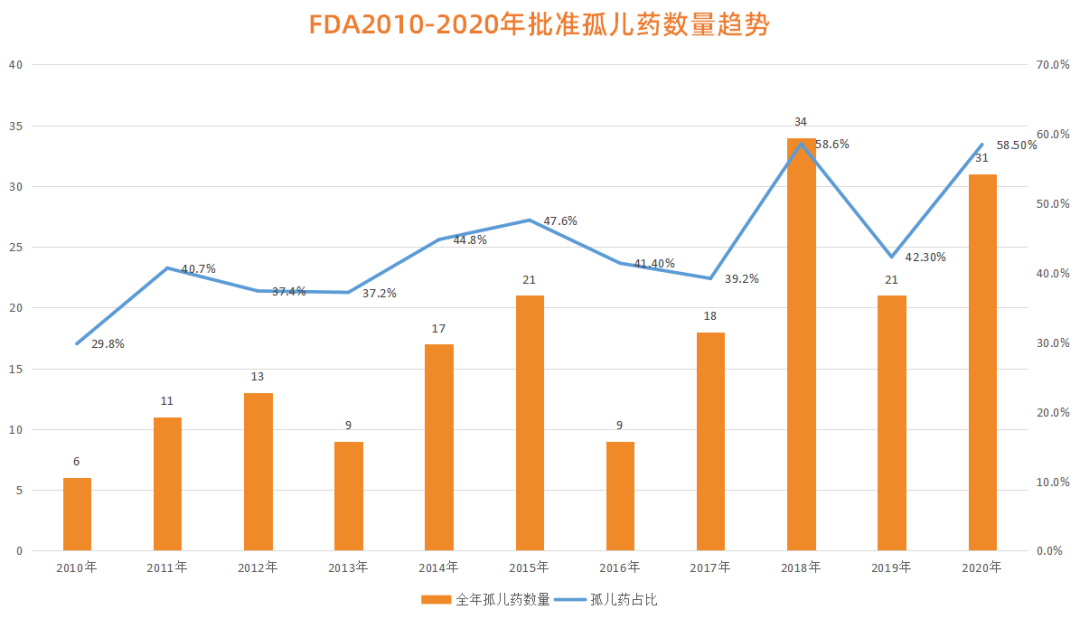
这一点在美国FDA批准的新药中得到了验证。据统计,在2010年到2020年期间,FDA批准的“孤儿药”数量呈现稳步上升的趋势。2010年,FDA批准的孤儿药数量仅有6个,而这一数值到2018年已达到了34个。在2020年,FDA批准的孤儿药数量为31个,占全年获批新药总数的58.5%,比值达到了10年来的新高。
除了数量的激增,研发成功率也在快速提升。根据最新发布的一份药物临床开发成功率报告显示,在2011年到2020年,孤儿药(不含肿瘤适应症)从1期临床到获得美国FDA批准上市的平均成功率为17%,高于整体药物的平均开发成功率7.9%。
但这些快乐都是别人的,因为到目前为止,中国有关“孤儿药”的研发成果几乎是一片空白。
这其中的原因很多也很复杂,比如技术上的问题、研发成本的问题、药物审批的问题、专利保护的问题、市场定价的问题、药物支付的问题等等,这些痛点在时间的演变中逐渐形成一种合力,在中国孤儿药市场上打了一个“死结”。
但这并不代表没有解决方法,推动孤儿药研发最有效的方式就是建立一套成熟有效的激励政策。
以美国为例。1983年之前,美国上市的孤儿药只有38种,但从1983年《孤儿药法案》颁布至今,已有500多种孤儿药被新批准上市。《孤儿药法案》的颁布为美国原本死气沉沉的孤儿药研发领域注入了全新的生机与活力。
这个《孤儿药法案》为何如此奏效呢?这主要归功于法案所包含的四个主要经济激励措施。
一是孤儿药一旦通过FDA认定,即可获得7年的市场独占权,在这7年里,FDA将不再批准针对相同适应症的新药上市,除非这款新药被证明比先前的药物更有效,在没有竞争对手、处于垄断地位的情况下,药企就可以收获相当可观的经济回报,该独占权被认为是最强有力的激励手段。
另外三个分别是给予孤儿药特殊的税费优惠、向孤儿药公司提供开发补助及研究基金和FDA为孤儿药公司提供临床试验的咨询与协助。这些措施在为药企减轻研发成本的同时,也解决了药企在研发之中所遇到的各种难题,这对于提高研发成功率有很大帮助。
一名国内药企高管在采访中告诉动脉网,“并非不是我们不愿意去研发孤儿药,主要是它临床试验难度很大,投入的成本又很高,如果没有资金和政策的支持,根本没有企业有勇气、有能力去做这样的事情。”
这完全能够理解,毕竟药企终归是需要盈利的,即便是再有人文关怀,在巨大的经济压力面前,也不可能完全“用爱发电”,只靠情怀必然是行不通的。
换一个角度讲,任何事物的正向发展都需要建立在一个平衡的体系,如果有一方重了或轻了,合作就很难再进行下去。因此,在孤儿药的研发上,药企不应该被片面地敌视,而是需要真正的激励。
在“孤儿药”上,我们不能永远依赖进口
当前,我国孤儿药长期依赖进口,但这并不是长久之计。
一方面,在医药领域,没有核心技术就等于没有话语权,国内“孤儿病”患者会非常被动;另一方面,我国“孤儿病”患者数量正在激增,根据数据显示,我国目前“孤儿病”患者人数约为2000万,其中50%为儿童,每年新增“孤儿病”病例超过20万。
所以我们需要在“孤儿药”上实现“国产替代”。站在这一目标之上,一些积极的信号正在释放。
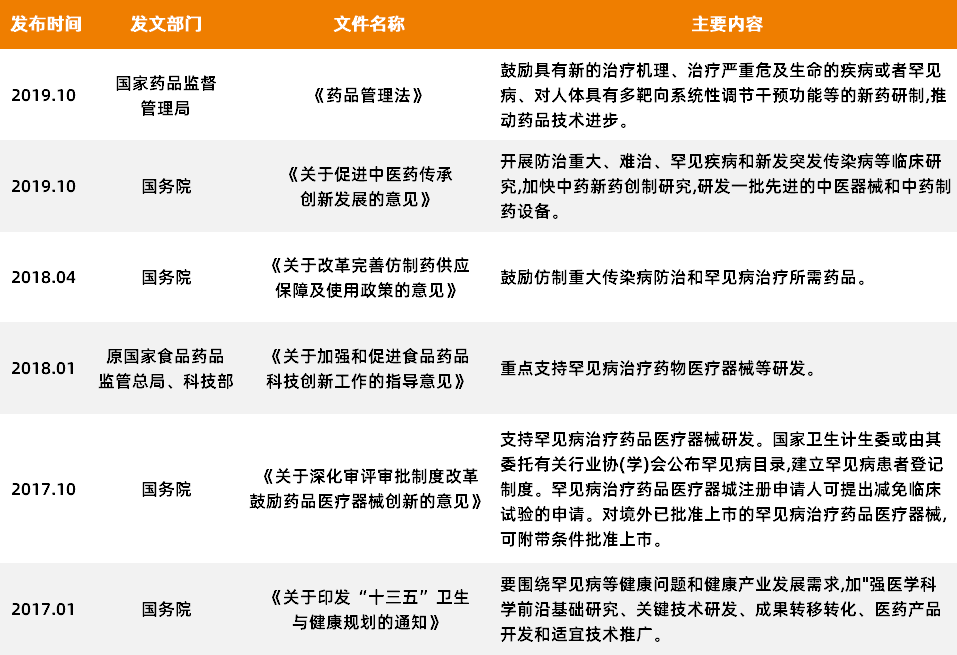
首先在政策端,相关政府部门针对性地出台了一系列“孤儿病”利好政策,包括优化审评审批、临床试验数据和知识产权保护等,多项政策的落实在为国内药企扫清研发障碍的同时,也增强了国内药企加大对孤儿药研发投入的信心。
其次在支付端,“孤儿病”患者可以享受的保障方式开始趋向多元化,在刚刚结束的医保谈判中,共有7款“孤儿病”用药进入医保。特别值得一提的是,这是国内首次高值“孤儿药”纳入医保体系。
除此之外,地方也在积极探索不同的“孤儿病”保障模式,诸如“惠蓉保”“穗岁康”等在内,多地陆续落地“惠民保”这一普惠型商业补充医疗保险,覆盖了部分“孤儿病”药物,这在一定程度上为“孤儿病”群体提供了保障。
最后在企业端,当前,市场上已诞生了像北海康成、应诺医药、北京科信必成等专注于孤儿病用药的国有研发企业,其中国内孤儿药先行者北海康成已于今年12月10日在港交所上市,这让药企甚至资本看到了孤儿药研发在中国的成功路径和市场前景。
根据数据显示,我国“孤儿药”市场规模预计5到10年内会突破100亿美元,这无疑是一片巨大的蓝海市场,但想要上岸,还需要这条创新生态链上的每一个参与方的努力。尤其是药企,他们是创新的起源,需要肩负起更多的责任,但同时也应该得到与其付出相匹配的回报,这是一种双赢的选择。
只有这样,才能推动更多孤儿药走向市场,才能让更多的人有生的希望,才能真正实现“不放弃每一个小群体”。