本周(9月2日至9月8日)基药目录调整引发关注,国家药监局密集对4类药品提出说明书修订。在企业层面,第二次闯关IPO的国内医疗器械龙头迈瑞医疗在7月24日过会后获得证监会IPO批文,意味着上市在即,而募资规模将会出现较大幅度缩水;药明康德(603259.SH)H股上市进程再进一步,申请材料获得证监会受理。研发方面,包括恒瑞医药(600276.SH)在内的4家企业产品在上市注册阶段取得进展,复星医药(600196.SH)引入的CAR-T(嵌合抗原受体T细胞免疫疗法,一种针对肿瘤的新型细胞疗法)产品获得临床试验批准。
行业政策
本周多个产品被要求修订说明书,基药目录调整引发业内关注,新版目录将出台。9月5日至9月7日,国家药监局总共发布了4个公告,要求对万通筋骨片、谷胱甘肽注射剂、含可待因感冒药、刺五加注射液4类产品修订说明书。
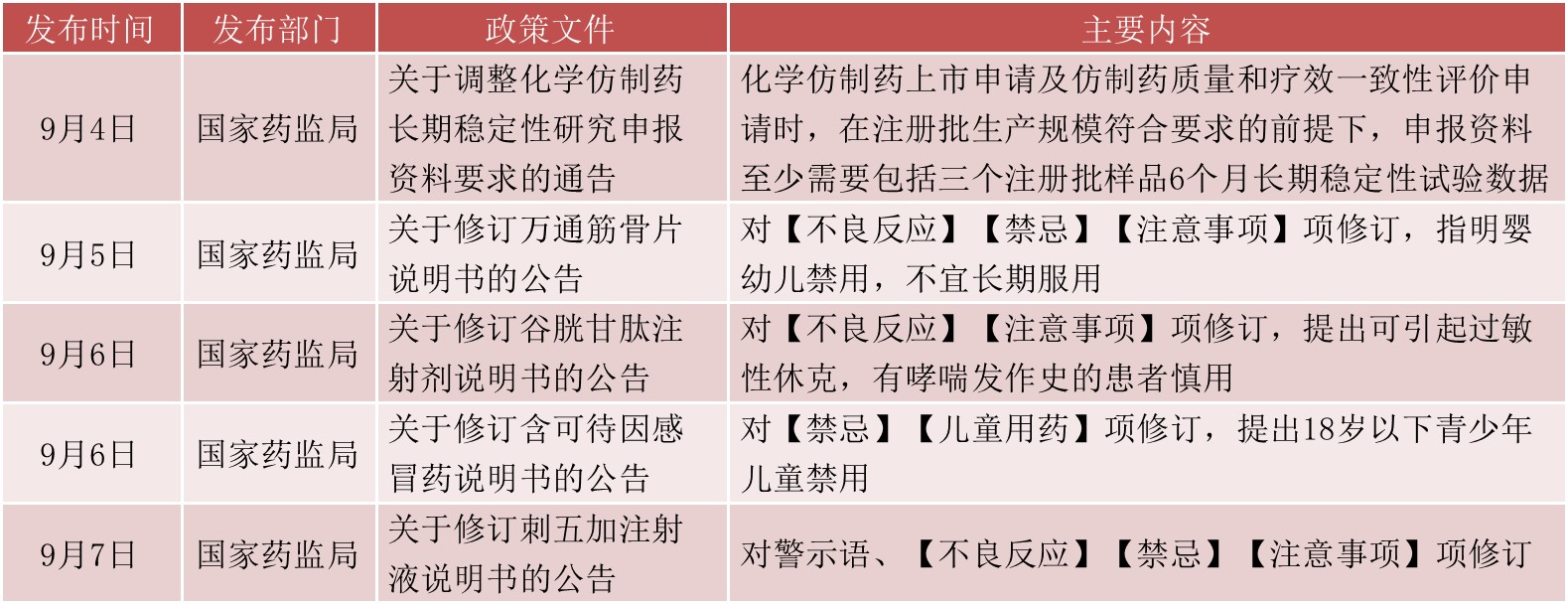
据国家药监局,万通筋骨片为通化万通药业股份有限公司的独家品种,用于痹症、肩周炎、颈椎病、腰腿痛等病症。谷胱甘肽注射剂涉及三种剂型,其中注射用还原型谷胱甘肽的国产批文20个,进口批文1个;注射用还原型谷胱甘肽钠的国产批文4个,进口批文1个;注射用谷胱甘肽的国产批文2个。刺五加注射液有8个国产药品批文。随着此次修订说明书,加之辅助用药监控加强,这两个注射剂市场或面临变数。另外对可待因感冒药提出修订,新增18岁以下青少年儿童禁用,这借鉴了国外监管机构的监管策略及风险信息,有利于提高用药安全。
另外,9月5日,在国务院政策例行吹风会上,国家卫健委副主任曾益新等就基药目录相关问题答记者问。本次目录调整,坚持调入调出并重,中西药并重,共调入药品187种,调出22种,目录总品种数量由原来的520种增加到685种,其中西药417种、中成药268种。调出目录的品种主要是临床已有可替代的药品,或者不良反应多、疗效不确切、临床已被逐步淘汰等原因。这意味着新版基药目录将出台,同时明确了地方无权增补,而未通过一致性评价的基药仿制药将被调出目录。
重要动态

迈瑞医疗获得IPO批文募资缩水
9月7日,证监会称,核准了2家企业的首发申请,包括上交所主板的天风证券股份有限公司,以及深交所创业板的深圳迈瑞生物医疗电子股份有限公司。上述企业及其承销商将分别与交易所协商确定发行日程,并陆续刊登招股文件。这2家企业融资总额不超过69亿元。
简评:作为国内最大的医疗器械企业,迈瑞医疗是继药明康德之后第二家通过IPO回归的中概股,这是该公司第二次闯关IPO。此次上市后,迈瑞医药有望成为A股医疗器械行业老大,并跻身创业板市值前三甲。最新招股书显示,公司拟公开发行近1.22亿股,募资净额为63.4亿元;若按该募资发行,迈瑞医疗将刷新宁德时代(300750.SZ)创下的54.6亿元的创业板最高募资纪录。但根据证监会此次核发的IPO批文,迈瑞医疗和天风证券合计拟募资不超过69亿元,意味着迈瑞医疗实际募资额度将会出现较大幅度缩水。
药明康德H股上市申请获受理
9月4日晚,药明康德(603259.SH)称,公司近日向证监会递交了关于公司拟发行H股并在香港联交所主板挂牌上市的申请材料,证监会审查后认为该申请材料齐全,符合法定形式,决定对该行政许可申请予以受理,公司已收到证监会出具的行政许可申请受理单。
简评:从迅速过会在5月8日实现A股上市,到董事会于7月初通过H股上市决议,再到此次获得证监会受理,药明康德持续推进两地上市进程。公司也可获得更多融资需求和发展机会,此次募集资金将用于扩大运营规模、投资建设、收购兼并、偿还贷款及补充流动资金等项目。此次发行上市还需取得证监会、香港联合交易所等机构核准,总体来看最终获批可能性较大。目前公司A股市值为917亿元,较此前峰值跌去近37%。
天士力就独家品种开发销售与美国药企合作
9月6日晚,天士力(600535.SZ)称,控股子公司天士力(北美)药业有限公司与美国Arbor Pharmaceuticals, Inc.(简称Arbor)三方签署协议,Arbor将出资最高2300万美金的研发付款,与天士力方共同进行复方丹参滴丸(美国FDA临床研究申报代码T89)美国FDA临床开发研究和药政申报;天士力方则将T89相关适应症在美国本土的独家销售权有偿许可给Arbor公司;产品上市后,天士力方可获得最高5000万美金的销售里程碑付款,以及按照毛利分层提取最高可达毛利50%的销售分成(特许权使用费)。
简评:复方丹参滴丸是天士力独家开发研制的主要用于预防和治疗心血管疾病的现代创新复方中药,此前曾两次获得美国FDA的临床试验批准,确定了预防和治疗慢性稳定性心绞痛的临床适应症;今年又获得FDA对另一新临床适应症的临床试验批准,用于预防和治疗急性高原综合征,是全球申报美国FDA新药的首例复方中药。此次合作有望发挥天士力的新药研发优势以及Arbor公司在美国地区处方药市场销售的优势,推进T89在美国上市,助推天士力中药产品国际化进程。
花园生物实控人推出兜底式增持
9月3日晚,花园生物(300401.SZ)称,公司实控人邵钦祥发出倡议,鼓励集团职员积极买入公司股票,并承诺在9月5日至9月28日期间以不超过18元/股的价格买入公司股票,且连续持有12个月以上并在职的职员,若在此期间产生亏损则由邵钦祥予以全额补偿,若产生收益则归集团职员个人所有。
简评:花园生物是维生素D3行业龙头企业,受益于国外企业停产、国内环保等因素,维生素D3价格从去年下半年开始触底反弹,公司去年和今年上半年业绩也因此翻倍增长。该股股价也随之波动上涨,但在5月底创下历史峰值后开始急剧下跌。此次实控人推出兜底式增持提振股价意图明显,9月4日该股大幅高开,收盘上涨2.2%,但此后股价并未保持上涨,看来效果并不具有持续性。
其他药讯
众生药业子公司因环保违规被罚30万
9月7日晚,众生药业(002317.SZ)称,全资子公司广东先强药业收到广州市从化区环境保护局行政处罚决定书。因废水排放指标不达标以及废水排放未经防范措施,责令先强药业停产整治十日,并处罚款合计30万元。先强药业去年实现收入2.32亿元,净利润8581万元,占公司去年净利润的20.42%。
圣达生物约1.36亿元收购亏损企业
9月7日晚,圣达生物(603079.SH)称,拟以现金5634万元收购通辽市黄河龙生物工程有限公司61.67%股权,并对其现金增资8000万元。交易完成后,圣达生物将持有标的公司75%股权。标的公司是一家从事维生素B2、黄原胶等食品和饲料添加剂的企业,与圣达生物属于同一行业领域,今年上半年亏损1588万元。
塞力斯和诚意药业股东计划减持
9月7日晚,塞力斯(603716.SH)称,持股5.12%的股东宿迁天沐君合投资管理中心(有限合伙)计划自公告披露之日起十五个交易日后的一个月内将减持不超过近103万股,即不超过公司股份总数的0.5%。
9月4日晚,诚意药业(603811.SH)称,合计持有公司13.38%股份的董监高任秉钧、庄小萍、沈爱兰、厉市生、邱克荣、张孚甫、张志宏、林昕晨、吕孙战等9名人员计划减持不超过近250万股,占公司股本比例为2.93%。9月5日,公司股价大跌7.06%。
海正药业降糖药瑞易宁供货出现紧张
9月2日晚,海正药业(600267.SH)称,控股子公司瀚晖制药有限公司主要产品格列吡嗪控释片(商品名瑞易宁,适用于糖尿病)由于生产方辉瑞旗下的波多黎各工厂受“玛丽亚”飓风影响,产能受损严重,造成中国市场的瑞易宁成品出现一定程度的供货紧张。今年前8月辉瑞方实际供货量仅有近219万盒,仅完成承诺供货量的63%。瑞易宁2017年收入为近1.83亿元,占公司营收的1.73%;毛利为0.95亿元,占2017年毛利总额的2.84%。
研发进展
4家企业产品取得注册进展
本周恒瑞医药(600276.SG)、人福医药(600079.SH)、科伦药业(002422.SZ)、智飞生物(300122.SZ)4家企业产品在上市注册阶段取得进展,其中智飞生物为生产注册获得受理,另外3家企业均为获得注册批件。
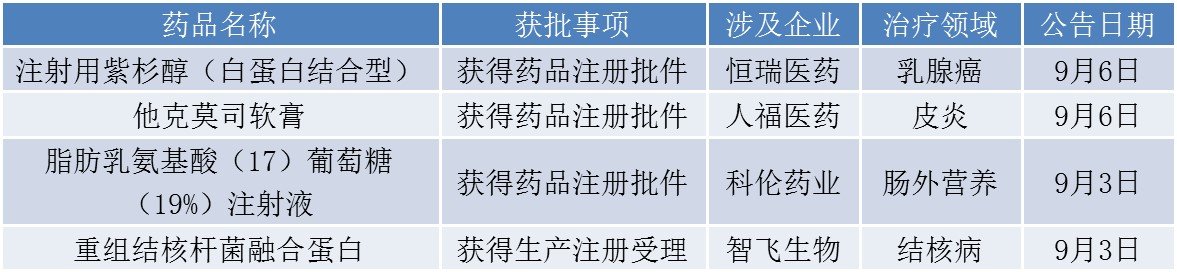
恒瑞医药此次获得注册批件的注射用紫杉醇(白蛋白结合型)用于治疗联合化疗失败的转移性乳腺癌或辅助化疗后6个月内复发的乳腺癌,公司在已投入研发费用约为3429万元。据IMS数据库,该产品去年中国销售额约为2.7亿美元。目前国内现有该药品的进口药和石药集团的仿制药获批上市销售,恒瑞医药在抢首仿中败于石药集团;国内还有齐鲁制药、海正药业、江苏康禾等多家企业提交的注册申请正在审评审批。
另外,科伦药业的肠外营养用药脂肪乳氨基酸(17)葡萄糖(19%)在国内仅有公司注册申报,公司为国内首家获得该产品生产批件的企业。智飞生物的重组结核杆菌融合蛋白(EC)是国内外首个完成Ⅲ期临床试验的此类产品,后续在申报GMP认证合格后即可上市销售。
3家企业在临床初期取得进展
本周还有复星医药(600196.SH)、华海药业(600521.SH)、珍宝岛(603567.SH)3家企业产品在临床初期获得进展,其中复星医药和华海药业为获得临床试验批准,珍宝岛为获得新药注册申请受理。

复星医药此次获批临床试验的产品拟用于复发难治性大B细胞淋巴瘤治疗,该产品系参股公司复星凯特从美国企业Kite Pharma引进的抗人CD19 CAR-T细胞注射液(商品名Yescarta)。去年10月Yescarta获美国FDA批准于美国上市,并于今年8月获欧洲EMA批准于欧洲上市。目前尚无与该产品具有相同靶点的同类药物在中国境内(不包括港澳台地区)上市,复星凯特拟于近期条件具备后开展该产品的临床I期试验。
国内目前有多家企业开展CAR-T疗法的研发,去年12月11日,南京传奇生物提交的CAR-T疗法的临床申请获得药审中心正式承办受理,随后银河生物(000806.SZ)的CAR-T产品的临床试验材料也转交给国家药监局审核。
另外,珍宝岛此次新药注册申请获得受理的产品系公司与上海药明康德新药开发有限公司共同进行研究开发的1类创新药物,公司拥有自主知识产权,目前已累计投入研发费用约2600万元,后续通过药品审评中心审评后方可开展临床相关工作。





